QUÍMICA TECNOLÓGICA
O equilíbrio da decomposição da amonia pode ser representado pela equação química, não balanceada:
NH3 (g) <==> N2 (g) + H2 (g)
As variações das concentrações com o tempo estão ilustradas no gráfico abaixo.
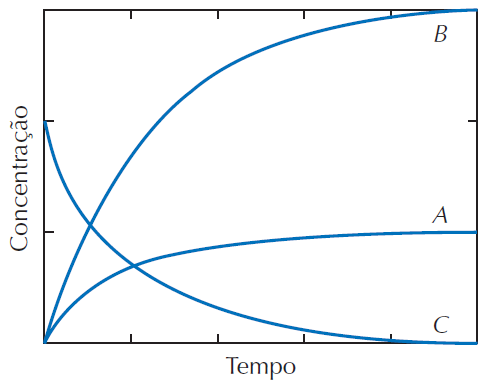
A partir da análise do gráfico, podemos afirmar que as curvas A, B e C representam a variação das concentrações dos seguintes componentes da reação, respectivamente:
NH3, H2 e N2
NH3, N2 e H2
N2, H2 e NH3
H2, N2 e NH3
H2, NH3 e N2
Extraiu-se, de uma jazida, 0,40 g de um certo óxido de ferro. Após análise, revelou que ele possui 0,28 g de ferro e 0,12 g de oxigênio. Qual é a fórmula percentual desse composto? Dados: Massa Molar em g/mol Fe = 56 ; O = 16
Fe50% O50%
Fe100%
Fe30% O70%
Fe70% O30%
Fe90% O10%
O alumínio apresenta a propriedade de se "auto-proteger", criando uma camada de óxido de alumínio que impede a oxidação, quando ele fica exposto ao ar. Porém, esquadrias de alumínio poder sofre corrosão quando expostas à chuvas ácidas. A reação química que pode ocorrer nesses casos é:
Al + H2SO4 → Al2(SO4)3 + H2
Sobre essa reação podemos afirmar que:
A reação está balanceada.
Há quantidades iguais de átomos de alumínio nos produtos que nos reagentes.
A massa dos reagentes é o triplo da massa dos produtos.
Os coeficientes que ajustam a equação são: 2,3,1 e 3.
todas as alternativas estão corretas.
O composto B5H9 poderia ser um excelente combustível para foguetes em virtude da grande quantidade de energia liberada na sua combustão, demonstrada na equação abaixo:
....... B5H9 + ........ O2 ---> ........ B2O3 + ....... H2O
A alternativa que contem os coeficientes estequiométricos para balancear essa equação é:
3 ; 2 ; 5 ; 10.
2 ; 2 ; 10 ; 2.
1 ; 1 ; 3 ; 12.
2 ; 12 ; 5 ; 9.
1 ; 10 ; 1 ; 5.
O Cloreto de Cálcio é um agente exotérmico deliquescente com propriedades descongelantes e anti-congelantes usado na estabilização de massas de cimento. Qual a fórmula do composto formado pelos elementos 20Ca40 e 17Cl35 e qual o tipo de ligação envolvida?
CaCl, iônica.
Ca2Cl, iônica.
CaCl2, iônica.
CaCl2, covalente.
CaCl, covalente.
O titânio é um metal duro, de alta resistência e por isso é utilizado para fabricar objetos e estruturas que serão submetidas a um grande esforço, como caixa-preta de aviões e pinos de implantes dentários. É possível de ser obtido a partir do tetracloreto de titânio por meio da reação não-balanceada:
TiCl4 (g) + Mg (s) ---> MgCl2 (l) + Ti (s)
Considere que essa reação foi iniciada com 9,5 g de TiCl4 (g). Supondo-se que tal reação seja total, a massa de titânio obtida será, aproximadamente:
1,2g
7,2 g
3,6g
4,8 g
2,4g
A água oxigenada é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
4,0% e 4,0%
5,9% e 94,1%
2% e 2%
50% e 50%
2% e 32%
A chuva ácida que cai em certas regiões danifica as estátuas de mármore (CaCO3). Considerando-se que a chuva ácida contenha ácido sulfúrico, a reação que ocorre é:
CaCO3 + H2SO4 -----> CaSO4 + H2O + CO2.
Se somarmos todos os coeficientes estequiométricos da reação acima, balanceada, obteremos o valor de:
13
8
5
11
7
Óxidos de nitrogênio, NOx , são substâncias de interesse ambiental, pois são responsáveis pela destruição de ozônio na atmosfera, e, portanto, suas reações são amplamente estudadas. Num dado experimento, em um recipiente fechado, a concentração de NO2 em função do tempo apresentou o seguinte comportamento:
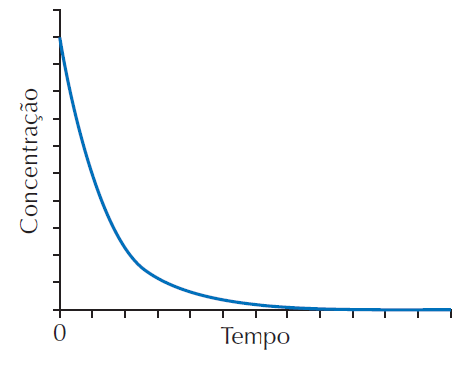
O papel de NO2 nesse sistema reacional é:
inerte.
reagente.
produto.
catalisador.
intermediário.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?

NH3, H2 e N2
NH3, N2 e H2
N2, H2 e NH3
H2, N2 e NH3
H2, NH3 e N2
Extraiu-se, de uma jazida, 0,40 g de um certo óxido de ferro. Após análise, revelou que ele possui 0,28 g de ferro e 0,12 g de oxigênio. Qual é a fórmula percentual desse composto? Dados: Massa Molar em g/mol Fe = 56 ; O = 16
Fe50% O50%
Fe100%
Fe30% O70%
Fe70% O30%
Fe90% O10%
O alumínio apresenta a propriedade de se "auto-proteger", criando uma camada de óxido de alumínio que impede a oxidação, quando ele fica exposto ao ar. Porém, esquadrias de alumínio poder sofre corrosão quando expostas à chuvas ácidas. A reação química que pode ocorrer nesses casos é:
Al + H2SO4 → Al2(SO4)3 + H2
Sobre essa reação podemos afirmar que:
A reação está balanceada.
Há quantidades iguais de átomos de alumínio nos produtos que nos reagentes.
A massa dos reagentes é o triplo da massa dos produtos.
Os coeficientes que ajustam a equação são: 2,3,1 e 3.
todas as alternativas estão corretas.
O composto B5H9 poderia ser um excelente combustível para foguetes em virtude da grande quantidade de energia liberada na sua combustão, demonstrada na equação abaixo:
....... B5H9 + ........ O2 ---> ........ B2O3 + ....... H2O
A alternativa que contem os coeficientes estequiométricos para balancear essa equação é:
3 ; 2 ; 5 ; 10.
2 ; 2 ; 10 ; 2.
1 ; 1 ; 3 ; 12.
2 ; 12 ; 5 ; 9.
1 ; 10 ; 1 ; 5.
O Cloreto de Cálcio é um agente exotérmico deliquescente com propriedades descongelantes e anti-congelantes usado na estabilização de massas de cimento. Qual a fórmula do composto formado pelos elementos 20Ca40 e 17Cl35 e qual o tipo de ligação envolvida?
CaCl, iônica.
Ca2Cl, iônica.
CaCl2, iônica.
CaCl2, covalente.
CaCl, covalente.
O titânio é um metal duro, de alta resistência e por isso é utilizado para fabricar objetos e estruturas que serão submetidas a um grande esforço, como caixa-preta de aviões e pinos de implantes dentários. É possível de ser obtido a partir do tetracloreto de titânio por meio da reação não-balanceada:
TiCl4 (g) + Mg (s) ---> MgCl2 (l) + Ti (s)
Considere que essa reação foi iniciada com 9,5 g de TiCl4 (g). Supondo-se que tal reação seja total, a massa de titânio obtida será, aproximadamente:
1,2g
7,2 g
3,6g
4,8 g
2,4g
A água oxigenada é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
4,0% e 4,0%
5,9% e 94,1%
2% e 2%
50% e 50%
2% e 32%
A chuva ácida que cai em certas regiões danifica as estátuas de mármore (CaCO3). Considerando-se que a chuva ácida contenha ácido sulfúrico, a reação que ocorre é:
CaCO3 + H2SO4 -----> CaSO4 + H2O + CO2.
Se somarmos todos os coeficientes estequiométricos da reação acima, balanceada, obteremos o valor de:
13
8
5
11
7
Óxidos de nitrogênio, NOx , são substâncias de interesse ambiental, pois são responsáveis pela destruição de ozônio na atmosfera, e, portanto, suas reações são amplamente estudadas. Num dado experimento, em um recipiente fechado, a concentração de NO2 em função do tempo apresentou o seguinte comportamento:

O papel de NO2 nesse sistema reacional é:
inerte.
reagente.
produto.
catalisador.
intermediário.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?
Fe50% O50%
Fe100%
Fe30% O70%
Fe70% O30%
Fe90% O10%
O alumínio apresenta a propriedade de se "auto-proteger", criando uma camada de óxido de alumínio que impede a oxidação, quando ele fica exposto ao ar. Porém, esquadrias de alumínio poder sofre corrosão quando expostas à chuvas ácidas. A reação química que pode ocorrer nesses casos é:
Al + H2SO4 → Al2(SO4)3 + H2
Sobre essa reação podemos afirmar que:
A reação está balanceada.
Há quantidades iguais de átomos de alumínio nos produtos que nos reagentes.
A massa dos reagentes é o triplo da massa dos produtos.
Os coeficientes que ajustam a equação são: 2,3,1 e 3.
todas as alternativas estão corretas.
O composto B5H9 poderia ser um excelente combustível para foguetes em virtude da grande quantidade de energia liberada na sua combustão, demonstrada na equação abaixo:
....... B5H9 + ........ O2 ---> ........ B2O3 + ....... H2O
A alternativa que contem os coeficientes estequiométricos para balancear essa equação é:
3 ; 2 ; 5 ; 10.
2 ; 2 ; 10 ; 2.
1 ; 1 ; 3 ; 12.
2 ; 12 ; 5 ; 9.
1 ; 10 ; 1 ; 5.
O Cloreto de Cálcio é um agente exotérmico deliquescente com propriedades descongelantes e anti-congelantes usado na estabilização de massas de cimento. Qual a fórmula do composto formado pelos elementos 20Ca40 e 17Cl35 e qual o tipo de ligação envolvida?
CaCl, iônica.
Ca2Cl, iônica.
CaCl2, iônica.
CaCl2, covalente.
CaCl, covalente.
O titânio é um metal duro, de alta resistência e por isso é utilizado para fabricar objetos e estruturas que serão submetidas a um grande esforço, como caixa-preta de aviões e pinos de implantes dentários. É possível de ser obtido a partir do tetracloreto de titânio por meio da reação não-balanceada:
TiCl4 (g) + Mg (s) ---> MgCl2 (l) + Ti (s)
Considere que essa reação foi iniciada com 9,5 g de TiCl4 (g). Supondo-se que tal reação seja total, a massa de titânio obtida será, aproximadamente:
1,2g
7,2 g
3,6g
4,8 g
2,4g
A água oxigenada é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
4,0% e 4,0%
5,9% e 94,1%
2% e 2%
50% e 50%
2% e 32%
A chuva ácida que cai em certas regiões danifica as estátuas de mármore (CaCO3). Considerando-se que a chuva ácida contenha ácido sulfúrico, a reação que ocorre é:
CaCO3 + H2SO4 -----> CaSO4 + H2O + CO2.
Se somarmos todos os coeficientes estequiométricos da reação acima, balanceada, obteremos o valor de:
13
8
5
11
7
Óxidos de nitrogênio, NOx , são substâncias de interesse ambiental, pois são responsáveis pela destruição de ozônio na atmosfera, e, portanto, suas reações são amplamente estudadas. Num dado experimento, em um recipiente fechado, a concentração de NO2 em função do tempo apresentou o seguinte comportamento:

O papel de NO2 nesse sistema reacional é:
inerte.
reagente.
produto.
catalisador.
intermediário.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?
A reação está balanceada.
Há quantidades iguais de átomos de alumínio nos produtos que nos reagentes.
A massa dos reagentes é o triplo da massa dos produtos.
Os coeficientes que ajustam a equação são: 2,3,1 e 3.
todas as alternativas estão corretas.
O composto B5H9 poderia ser um excelente combustível para foguetes em virtude da grande quantidade de energia liberada na sua combustão, demonstrada na equação abaixo:
....... B5H9 + ........ O2 ---> ........ B2O3 + ....... H2O
A alternativa que contem os coeficientes estequiométricos para balancear essa equação é:
3 ; 2 ; 5 ; 10.
2 ; 2 ; 10 ; 2.
1 ; 1 ; 3 ; 12.
2 ; 12 ; 5 ; 9.
1 ; 10 ; 1 ; 5.
O Cloreto de Cálcio é um agente exotérmico deliquescente com propriedades descongelantes e anti-congelantes usado na estabilização de massas de cimento. Qual a fórmula do composto formado pelos elementos 20Ca40 e 17Cl35 e qual o tipo de ligação envolvida?
CaCl, iônica.
Ca2Cl, iônica.
CaCl2, iônica.
CaCl2, covalente.
CaCl, covalente.
O titânio é um metal duro, de alta resistência e por isso é utilizado para fabricar objetos e estruturas que serão submetidas a um grande esforço, como caixa-preta de aviões e pinos de implantes dentários. É possível de ser obtido a partir do tetracloreto de titânio por meio da reação não-balanceada:
TiCl4 (g) + Mg (s) ---> MgCl2 (l) + Ti (s)
Considere que essa reação foi iniciada com 9,5 g de TiCl4 (g). Supondo-se que tal reação seja total, a massa de titânio obtida será, aproximadamente:
1,2g
7,2 g
3,6g
4,8 g
2,4g
A água oxigenada é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
4,0% e 4,0%
5,9% e 94,1%
2% e 2%
50% e 50%
2% e 32%
A chuva ácida que cai em certas regiões danifica as estátuas de mármore (CaCO3). Considerando-se que a chuva ácida contenha ácido sulfúrico, a reação que ocorre é:
CaCO3 + H2SO4 -----> CaSO4 + H2O + CO2.
Se somarmos todos os coeficientes estequiométricos da reação acima, balanceada, obteremos o valor de:
13
8
5
11
7
Óxidos de nitrogênio, NOx , são substâncias de interesse ambiental, pois são responsáveis pela destruição de ozônio na atmosfera, e, portanto, suas reações são amplamente estudadas. Num dado experimento, em um recipiente fechado, a concentração de NO2 em função do tempo apresentou o seguinte comportamento:

O papel de NO2 nesse sistema reacional é:
inerte.
reagente.
produto.
catalisador.
intermediário.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?
3 ; 2 ; 5 ; 10.
2 ; 2 ; 10 ; 2.
1 ; 1 ; 3 ; 12.
2 ; 12 ; 5 ; 9.
1 ; 10 ; 1 ; 5.
O Cloreto de Cálcio é um agente exotérmico deliquescente com propriedades descongelantes e anti-congelantes usado na estabilização de massas de cimento. Qual a fórmula do composto formado pelos elementos 20Ca40 e 17Cl35 e qual o tipo de ligação envolvida?
CaCl, iônica.
Ca2Cl, iônica.
CaCl2, iônica.
CaCl2, covalente.
CaCl, covalente.
O titânio é um metal duro, de alta resistência e por isso é utilizado para fabricar objetos e estruturas que serão submetidas a um grande esforço, como caixa-preta de aviões e pinos de implantes dentários. É possível de ser obtido a partir do tetracloreto de titânio por meio da reação não-balanceada:
TiCl4 (g) + Mg (s) ---> MgCl2 (l) + Ti (s)
Considere que essa reação foi iniciada com 9,5 g de TiCl4 (g). Supondo-se que tal reação seja total, a massa de titânio obtida será, aproximadamente:
1,2g
7,2 g
3,6g
4,8 g
2,4g
A água oxigenada é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
4,0% e 4,0%
5,9% e 94,1%
2% e 2%
50% e 50%
2% e 32%
A chuva ácida que cai em certas regiões danifica as estátuas de mármore (CaCO3). Considerando-se que a chuva ácida contenha ácido sulfúrico, a reação que ocorre é:
CaCO3 + H2SO4 -----> CaSO4 + H2O + CO2.
Se somarmos todos os coeficientes estequiométricos da reação acima, balanceada, obteremos o valor de:
13
8
5
11
7
Óxidos de nitrogênio, NOx , são substâncias de interesse ambiental, pois são responsáveis pela destruição de ozônio na atmosfera, e, portanto, suas reações são amplamente estudadas. Num dado experimento, em um recipiente fechado, a concentração de NO2 em função do tempo apresentou o seguinte comportamento:

O papel de NO2 nesse sistema reacional é:
inerte.
reagente.
produto.
catalisador.
intermediário.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?
CaCl, iônica.
Ca2Cl, iônica.
CaCl2, iônica.
CaCl2, covalente.
CaCl, covalente.
O titânio é um metal duro, de alta resistência e por isso é utilizado para fabricar objetos e estruturas que serão submetidas a um grande esforço, como caixa-preta de aviões e pinos de implantes dentários. É possível de ser obtido a partir do tetracloreto de titânio por meio da reação não-balanceada:
TiCl4 (g) + Mg (s) ---> MgCl2 (l) + Ti (s)
Considere que essa reação foi iniciada com 9,5 g de TiCl4 (g). Supondo-se que tal reação seja total, a massa de titânio obtida será, aproximadamente:
1,2g
7,2 g
3,6g
4,8 g
2,4g
A água oxigenada é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
4,0% e 4,0%
5,9% e 94,1%
2% e 2%
50% e 50%
2% e 32%
A chuva ácida que cai em certas regiões danifica as estátuas de mármore (CaCO3). Considerando-se que a chuva ácida contenha ácido sulfúrico, a reação que ocorre é:
CaCO3 + H2SO4 -----> CaSO4 + H2O + CO2.
Se somarmos todos os coeficientes estequiométricos da reação acima, balanceada, obteremos o valor de:
13
8
5
11
7
Óxidos de nitrogênio, NOx , são substâncias de interesse ambiental, pois são responsáveis pela destruição de ozônio na atmosfera, e, portanto, suas reações são amplamente estudadas. Num dado experimento, em um recipiente fechado, a concentração de NO2 em função do tempo apresentou o seguinte comportamento:

O papel de NO2 nesse sistema reacional é:
inerte.
reagente.
produto.
catalisador.
intermediário.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?
1,2g
7,2 g
3,6g
4,8 g
2,4g
A água oxigenada é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
4,0% e 4,0%
5,9% e 94,1%
2% e 2%
50% e 50%
2% e 32%
A chuva ácida que cai em certas regiões danifica as estátuas de mármore (CaCO3). Considerando-se que a chuva ácida contenha ácido sulfúrico, a reação que ocorre é:
CaCO3 + H2SO4 -----> CaSO4 + H2O + CO2.
Se somarmos todos os coeficientes estequiométricos da reação acima, balanceada, obteremos o valor de:
13
8
5
11
7
Óxidos de nitrogênio, NOx , são substâncias de interesse ambiental, pois são responsáveis pela destruição de ozônio na atmosfera, e, portanto, suas reações são amplamente estudadas. Num dado experimento, em um recipiente fechado, a concentração de NO2 em função do tempo apresentou o seguinte comportamento:

O papel de NO2 nesse sistema reacional é:
inerte.
reagente.
produto.
catalisador.
intermediário.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?
4,0% e 4,0%
5,9% e 94,1%
2% e 2%
50% e 50%
2% e 32%
A chuva ácida que cai em certas regiões danifica as estátuas de mármore (CaCO3). Considerando-se que a chuva ácida contenha ácido sulfúrico, a reação que ocorre é:
CaCO3 + H2SO4 -----> CaSO4 + H2O + CO2.
Se somarmos todos os coeficientes estequiométricos da reação acima, balanceada, obteremos o valor de:
13
8
5
11
7
Óxidos de nitrogênio, NOx , são substâncias de interesse ambiental, pois são responsáveis pela destruição de ozônio na atmosfera, e, portanto, suas reações são amplamente estudadas. Num dado experimento, em um recipiente fechado, a concentração de NO2 em função do tempo apresentou o seguinte comportamento:

O papel de NO2 nesse sistema reacional é:
inerte.
reagente.
produto.
catalisador.
intermediário.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?
13
8
5
11
7
Óxidos de nitrogênio, NOx , são substâncias de interesse ambiental, pois são responsáveis pela destruição de ozônio na atmosfera, e, portanto, suas reações são amplamente estudadas. Num dado experimento, em um recipiente fechado, a concentração de NO2 em função do tempo apresentou o seguinte comportamento:

O papel de NO2 nesse sistema reacional é:
inerte.
reagente.
produto.
catalisador.
intermediário.
Um engenheiro foi contratado para construir um tanque de decantação, para conter resíduos líquidos de uma industria de tintas. O resíduo apresenta concentração de H+ igual a 1 x 10-8. Qual o pH desse resíduo?

inerte.
reagente.
produto.
catalisador.
intermediário.